Irányított fehérje-szabászat: az acilpeptid hidroláz szerkezetvizsgálata
A fehérjelánc elhasítását, a peptidkötés hidrolízisét végző enzimek működésekor nagyon fontos a működés szabályozása, például, hogy a funkciótól függően csak bizonyos fehérjéket, illetve csak kitüntetett helyeken legyenek képesek elhasítani (specificitás, szelektivitás). Ezen felül a működésük helyének/idejének kontrollálása is kulcsfontosságú, pl. az enzim "be- és kikapcsolásával", vagy gátlásával. A modern szerkezetvizsgálati módszerek (röntgendiffrakció és NMR-spektroszkópia) a molekula háromdimenziós szerkezetének meghatározásával a fehérjeműködés atomi szintű megértését teszik lehetővé, megkönnyítve ezzel akár jobb tulajdonságú molekulák (pl. gyógyszer, vagy növényvédőszer hatóanyagok, más célra hasznosítható enzimek) tervezését is. Vizsgálataink célpontja az acilpeptid hidroláz (APH) ami képes egy védett aminosavat lehasítani a fehérjelánc végéről. Két szerkezeti egységből (doménból) áll, amelyek közül az egyiken található az aktív hely, itt történik a reakciókatalízis, a másik méreténél fogva meggátolja kb. 30 aminosavasnál nagyobb fehérjék hozzáférését az aktív helyhez, ami a két domén közti üregben található (1. ábra). Ezzel a méret-szelektivitással függ össze az APH egyik funkciója is: neuropeptidek szintjének szabályozását végzi. Éppen ezért farmakológiai szempontból jelentős potenciállal bír, mint egyes memórianövelő gyógyszerek lehetséges célpontja. Működését bizonyos ráktípusokkal is összefüggésbe hozták, de ennek még tisztázatlan a mechanizmusa. Működésének megértése és esetleges későbbi szerkezet-alapú gyógyszerfejlesztés céljából régóta próbálják meghatározni térszerkezetét, ám mindeddig sikertelenül. Az emberi enzimmel ellentétben egy mikrobából, az Aeropyrum pernix K1-ből származó variánsának (ApAPH) sikerült meghatározni a szerkezetét, s ezért ezzel az enzimformával foglalkozunk mi is.
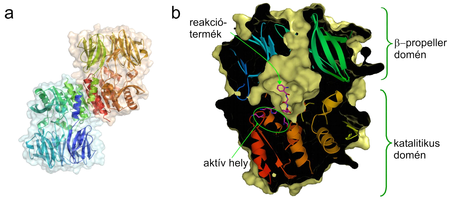
1.ábra
a: Az két molekulából álló homodimer ApAPH szalagmodellje és molekuláris felszíne.
b: Az egyik ApAPH molekula metszete a két domén, és a molekula üregében elhelyezkedő aktív hely feltüntetésével.
Kutatásaink egyik célja az emlős APH és a mikrobából származó ApAPH közti funkcionális különbség jellemzése: vajon mennyire jó modell az ApAPH [1]. Vizsgáltuk különféle peptidek elhasítását oldatban, és eredményeink azt mutatták, hogy az ApAPH más specificitású, mint az emlős enzim: előbbi elsősorban fenilalanin aminosav utáni helyen hasítja el a peptidláncot. A másik fontos különbség, hogy az ApAPH nem csak a peptidlánc széléről képes lehasítani egy védett aminosavat, hanem láncközi hasítást is képes elvégezni (ún. endopeptidáz). Meghatároztuk az ApAPH és különböző, az enzimreakció termékének megfelelő kis peptidek (2.a ábra) komplexeinek a szerkezetét. A szerkezetek alapján azonosíthatók a specificitást meghatározó régiók az enzimben: a nagyobb méretű hidrofób zseb, ami a hasítandó kötés előtti fenilalanint fogadja be (ún. S1 zseb), és a kis peptid azt megelőző két csoportját befogadó zsebek (S2 és S3), amelyek szintén hidrofób jellegűek (2.b ábra). A szerkezetek alapján egyértelmű, hogy nincs semmilyen szerkezeti elem, ami lezárná a kötőrégiót az enzimben, ez magyarázza az endopeptidáz aktivitást (2.c ábra). A szerkezet ismeretében már végezhetők olyan szerkezetmódosítások (pl. aminosav-mutációk) az ApAPH-ban, amelyek hatására hasonló szelektivitású lesz az emlős enzimekhez.
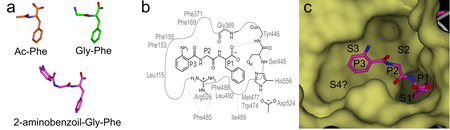
2. ábra Reakciótermék molekulákkal alkotott ApAPH komplexek szerkezetvizsgálata. a: A három vizsgált molekula a komplexben kötött konformációban. (Színezés: szén narancs/zöld/lila, oxigén piros, nitrogén kék, a hidrogén atomok nem látszanak.) b: A legnagyobb molekula kötésében részt vevő aminosavak (hidrogén kötések: szaggatott vonal). c: Az enzim molekuláris felszíne és a legnagyobb molekula a komplexben. Az ábra baloldalán látszik, hogy a kötőhely akár hosszabb peptidláncot is be tudna fogadni.
Felfedeztük továbbá egy érdekes tulajdonságát az enzimnek. A katalitikus aminosavaktól különálló hisztidin (His367) oldalláncának megváltoztatása az enzimaktivitást három nagyságrenddel lerontja. Ez a tulajdonság valószínűleg univerzális az APH enzimek körében, mivel ezen a helyen minden ismert APH enzimben hisztidin van (konzervált His). A His367 szerepének vizsgálata céljából meghatároztuk annak a mutáns enzimformának a szerkezetét is ahol hiányzik ennek az aminosavnak az oldallánca (a His367-et alaninra cseréltük) [2]. Az eredeti ApAPH és a mutáns szerkezetének összehasonlításakor kiderült, hogy a His367 szerepe az, hogy a katalitikus mechanizmusban részt vevő ún. oxianion hely egyik aminosavját, a Gly369-et tartó fehérjehurkot stabilizálja a szerkezetben (3. ábra). Az oxianion hely szerepe a katalitikus reakció során képződő átmeneti állapot stabilizálása azáltal, hogy hidrogénkötést létesít annak negatív töltésű oxigénjével. Az ábrán ehhez az oxigénhez hasonló helyzetben található a reakciótermék oxigénje az ApAPH kompexében, és megfigyelhető az Gly369 aminosavval létesített hidrogénkötés. A mutáns enzimben viszont a "tartó hurok" szerkezetének megváltozása miatt a Gly369 kedvezőtlen orientációban van. Eredményeink az oxianion zseb kialakítás egy újfajta módjának szerkezeti alapját derítették fel. Érdekes módon ez a szerkezeti elrendeződés APH enzimekkel rokon más proteázoknál nem található meg, csak néhány nagyon távoli homológiát mutató, más funkciójú enzimnél.
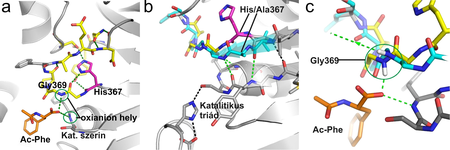
3. ábra A His367Ala mutáció hatása az ApAAP szerkezetére. a: A His367 környezete (a hidrogénkötéseket szaggatott vonal jelöli, az oxianion helyet alkotó két NH csoportot zöld karika). b: Az eredeti enzimben lilával és sárgával jelölt hurokrégió konformációja eltér az Ala367 mutáns formáétól (világoskék). c: Az előbbi ábra nagyítása. A mutáció hatására az oxianion hely torzul, az egyik NH csoport iránya nem megfeleő a hidrogénkötés kialakításához (zöld karika, az új irányt zöld szaggatott nyíl jelzi).
Letölthető összefoglaló (.pdf)
[1] Kiss AL, Hornung B, Rádi K, Gengeliczki Z, Sztáray B, Juhász T, Szeltner Z, Harmat V, Polgár L: The Acylaminoacyl Peptidase from Aeropyrum pernix K1 Thought to Be an Exopeptidase Displays Endopeptidase Activity, JOURNAL OF MOLECULAR BIOLOGY 368: 509-520 (2007)
[2] Kiss AL, Palló A, Náray-Szabó G, Harmat V, Polgár L: Structural and kinetic contributions of the oxyanion binding site to the catalytic activity of acylaminoacyl peptidase. JOURNAL OF STRUCTURAL BIOLOGY 162: 312-323 (2008)