Rendezetlen fehérje kötődésvizsgálata: kalpain/kalpasztatin rendszer
A biokémia egyik legfontosabb alapvetése a fehérje szerkezet-hatás összefüggés feltételezi, hogy a funkció a fehérjeszerkezeti motívumok segítségével valósul meg. Ezt a tételt erősítette az a tény is, hogy sokáig elválasztási nehézségek miatt csak globuláris fehérjéket izoláltak, csupán az 1980-as évektől azonban sikerült térszerkezettel nem rendelkező fehérjéket előállítani. A humán genom feltérképezése világított rá igazából a rendezetlen fehérjék (intrinsically unstructured protein, IUP) biológiai jelentőségére. Szerkezetjósló módszerekkel kimutatták, hogy az ismert rendezetlen vagy részben rendezetlen fehérjeszakaszok előfordulása a fejlettebb élőlényekben meghaladja a 30 %-ot [1,2]. Szerkezeti adottságaikból kifolyólag az IUP-k a fehérje-kölcsönhatási hálózatok ún. HUB fehérjéi között nagy gyakorisággal fordulnak elő (1.ábra).
A kalpain egy kalcium aktivált intracelluláris ciszteinproteáz, két alegységből álló heterodimer fehérje. A papain-szerű katalitikus domén a 80 kDa-os nagy alegység része, míg a 28 kDa-os kis alegység szabályozó funkciót lát el. A molekula több mint száz fehérje aktivitását szabályozza azáltal, hogy elhasítja őket (limitált proteolízis). Ezzel fontos szerepet játszik a sejtosztódási és differenciálódási folyamatokban valamint a sejt mozgásában. A kalpain szabályozásának hibás működése számos betegséget eredményezhet (muscle dystrophy, diabetes).
A kalpain egyetlen ismert specifikus fehérje-inhibitora a szervezetben a kalpasztatin [3]. Ez egy nem szövet-specifikus, rendezetlen fehérje. Az emberi kalpasztatin 708 aminosavból épül fel, 5 doménje van, melyből 4 (I,II,III,IV) homológ, ezek egy-egy kalpain molekula gátlására képesek. Az első domén (L) funkciója egyelőre ismeretlen (2. ábra).
A gátló doméneken belül három szekvenciálisan konzervált rövidebb szakasz ismerhető fel (A, B, C szubdomén). Részletes biokémiai vizsgálatok bizonyították, hogy elsősorban ezek a szakaszok felelősek a kalpasztatin kalpainhoz való kötődéséért, és az enzim gátlásáért. A három szubdomén közül az A és C kalciumfüggő módon kapcsolódik a kalpainhoz és feltehetően a kalpasztatinmolekula lehorgonyzásáért felelős. A gátlást a B szubdomén fejti ki: az enzim aktív centrumához kötődve gátolja a szubsztrátok hozzáférését (2.ábra).
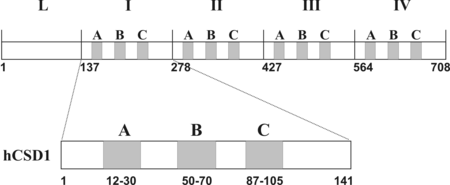
2. ábra A humán kalpasztatin domén szerkezete. Az L domén funkciója nem ismert. Az I. II. III. IV. domének egyenként képesek gátolni egy-egy kalpain molekula működését. Mind a négy inhibitor domén három szekvenciálisan konzervált régiót tartalmaz. Az A és C a molekula kalpainhoz való kötődéséért felelős, a B az inhibiciós hatást fejt ki.
Az MTA Enzimológiai Intézetben Tompa Péter kutatócsoportjával együttműködésben végzett vizsgálataink célja, hogy a kalpasztatin molekula szerkezeti tulajdonságait NMR spektroszkópiával jellemezzük oldatfázisban, szabad állapotban, valamint, hogy a kalpainhoz való kötődésének folyamatát feltérképezzük. Ehhez az első domént tartalmazó hCSD1 molekulát használtuk.
Ismert hogy a molekula szabad formában szerkezeti szempontból rendezetlen, a kötődési állandó értéke és a kölcsönhatás specifikussága azonban feltételezi előre megformált szerkezeti elemek meglétét is. Ezért elvégeztük a hCSD1 molekula NMR analízisét (másodlagos kémiai eltolódás, dinamikai tulajdonságok, pH- és hőmérsékletfüggés). A vizsgálat eredményeként megállapítottuk, hogy a molekula tartalmaz előre kialakult másodlagos szerkezeti elemeket, ezek a funkcionális doménekhez köthetőek, és szerepet játszanak a kalpainhoz való kötődés kinetikájában [4].
A kötődésvizsgálatok során megállapítottuk, hogy a kalpasztatin három különböző ponton kötődik a kalpain molekulához [5]. Ezek a pontok jól átfednek a konzervált szekvencia szakaszokkal, hasonlóan a komplex kristályszerkezetében tapasztaltakhoz (3. ábra).
A kristályszerkezet részletekkel szolgál a kötődő régiók kölcsönhatásairól, azonban a kötődés során bekövetkező dinamikai változásokról, és a konzervált szekvenciaszakaszok közötti hajlékony összekötő régióknak a kötődésben betöltött szerepéről, és változásairól nem ad információt. Az NMR adatokkal viszont jellemezni tudtuk a krisztallográfia számára láthatatlan szekvencia szakaszok változásait is a kötődés során. A teljes kötődést kiváltó kalciumszintnél alacsonyabb koncentrációt alkalmazva megfigyelhettük azt az átmeneti komplexet, amiben a kalpainhoz csak részlegesen, az A és C régió segítségével kötődik a kalpasztatin.
Letölthető összefoglaló (.pdf)
1. ábra Az élesztő gomba fehérje kölcsönhatási hálózata. Az élesztőgomba fehérjeinteraktom hálózatában a teljes fehérjeállomány majd 30%-a rendezetlen. A rendezetlen fehérjesszakaszok gyakoribbak, az ún. HUB fehérjék között. Ezeknek a fehérjéknek jellemzője, hogy több partnerrel képesek kölcsönhatásba lépni.
[1] Tompa, P: Trends Biochem Sci, 27: 527-533 (2002)
[2] Dyson, HJ, Wright PE: Curr Opin Struct Biol, 12: 54-60 (2002)
[3] Wendt A, Thompson, VF, Goll, DE:. Biol, Chem, 385: 465-472 (2004)
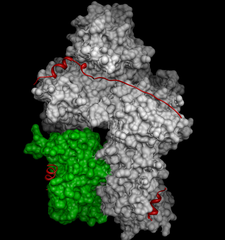
3.ábra Kalpainhoz kötött kaplasztatin kristályszerkezete [6]. A kalpain 80kDa-os alegysége fehér, 25kDa-os alegysége zöld színnel jelölve. Piros szalag jelöli a kötött kalpasztatin azonosított részleteit.
[4] Kiss R, Kovacs D, Tompa P, Perczel A: Biochemistry, 47: 6936-6945 (2008)
[5] Kiss R, Bozoky Z, Rona G, Friedrich P, Dvortsak P, Weisemann R, Tompa P, Perczel A: FEBS Lett, 582: 2149-2154 (2008)
[6] Hanna RA, Campbell RL, Davies PL Nature 456: 409-412 (2008)