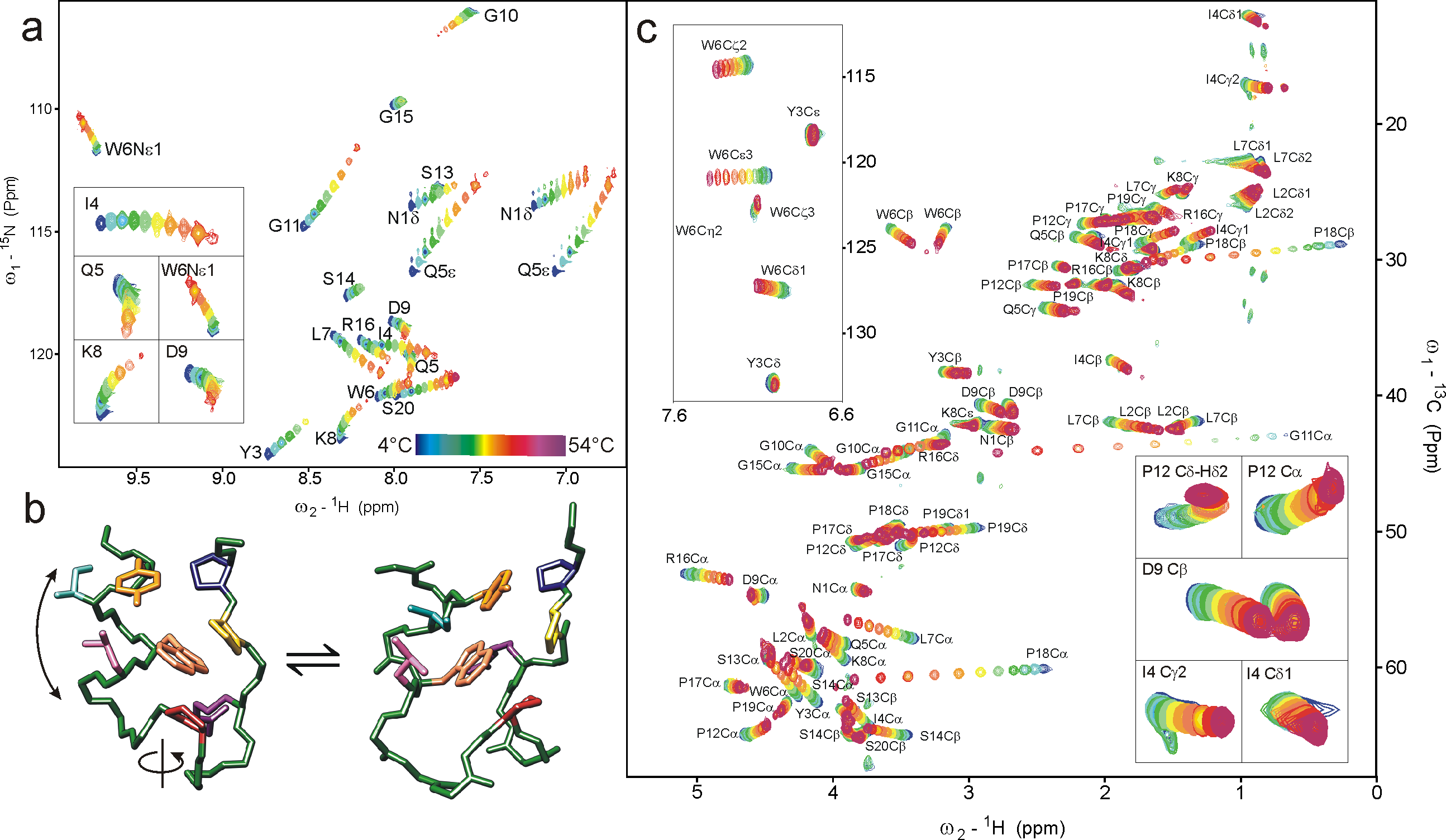
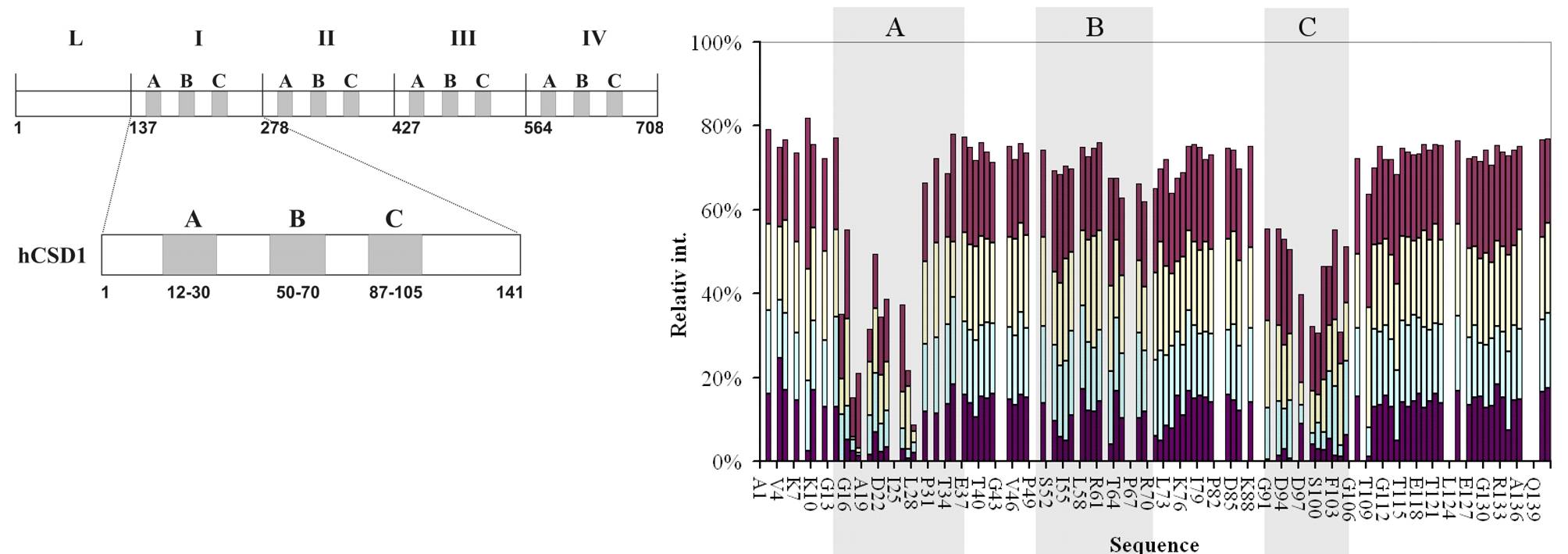
NMR laboratórium
Galléria: NMR laboratórium
Labor felelős: Dr. Perczel András
Munkatársak: Gadanecz Márton, Pilhál Fruzsina, Dr. Horváth Dániel , Dr. Láng András, Dr. Szalainé Ágoston Bianka
Összhangban a modern bioNMR spektroszkópia célkitűzéseivel, polipeptidek és fehérjék oldatfázisú térszerkezet-meghatározását, belső dinamikai tulajdonságaik feltérképezését, intermolekuláris kölcsönhatásaik és kötődésük vizsgálatát, valamint fel- és letekeredésük mélyebb megértését kutatjuk. Atomi felbontású adataink felölelik a rövidebb polipeptidek, a nagyobb globuláris és a belsőleg rendezetlen fehérjék, valamint egyes szupramolekuláris nanorendszerrek körét. Egyes polipeptidek és fehérjék aggregátumait, speciális amiloid típusú nanorendszerré történő átalakulását vizsgáljuk, amelyek jelentősége túlmutat az alapkutatás keretein. A megértésen és a racionális tervezésen alapuló munkánk katalizálhatja egyes szoros-illeszkedésű, kompakt makromolekulák és biokompatibilis nanorendszerek (pl. molekuláris ragasztók, térkitöltők, stb.) fejlesztését, valamint makromolekulák, membránmimetikumok, liposzómák, stb. közegfüggő szerkezetelemzését. Az amiloid képződésének és a fehérjék hibás feltekeredésének NMR spektroszkópiai monitorozása elvezethet az Alzheimer-kór kutatásának molekuláris részleteihez.
A 2017-ben érzékenyített mérőfejjel továbbfejlesztett 700 MHz-es készülékünkkel örömmel segítjük kémikus és biokémikus kollégáinkat azért, hogy kutatási területükön több és jobb molekuláris szintű információhoz juthassanak. Az NMR mérések érzékenységének növelése révén, a Prodigy mérőfejjel pontosabban és gyorsabban végezhetjük a minőségi és mennyiségi analízis különböző feladatait, amelyek jelentősége kiterjed az élelmiszeranalitika és az élelmiszerbiztonság számos területére. Hatékonyan tudunk kimutatni egyes adalékanyagokat, idegen és esetleg káros komponensek (pl. toxinok) mennyiségi meghatározását elvégezni.
Laboratórium hírei
-
VIP cikkünk a ChemEurJ.-ben

Izgalmas eredmények, új adatok a világ talán legkisebb feltekeredett fehérjéjéről. Atomi felbontás látható és „láthatatlan” téralkatokról: NMR és termodinamikai paraméterek meghatározása egy újonnan kidolgozott algoritmus segítségével. elérhetősége
Közlemények
-
Zoltán Gáspári , András Perczel
Protein dynamics as reported by NMR
Annu. Rep. NMR Vol. 71, in press (2010) -
Zoltán Gáspári , Annamária F. Ángyán , Somdutta Dhir , Dino Franklin , András Perczel , Alessandro Pintar , Sándor Pongor
Probing dynamic protein ensembles with atomic proximity measures
Curr. Protein Pept. Sci. 11(7):515-522. | DOI: 10.2174/138920310794109201 | PMID: 20887264 (2010) Kivonat -
Zoltán Gáspári , Péter Várnai , Balázs Szappanos , András Perczel
Reconciling the lock-and-key and dynamic views of canonical serine protease inhibitor action
FEBS Lett. 584(1):203-206. | DOI: 10.1016/j.febslet. | PMID: 19932101 (2010) Kivonat -
Katalin E. Kövér , Tamás Beke , András Lipták , András Perczel
Combined NMR three-bond scalar coupling measurements and QM calculations to calculate OH-rotamer equilibrium of polyalcohols
J. Comput. Chem. 30:540-550. (2009) Kivonat -
Zsuzsa Hódi , Attila L. Németh , László Radnai , Csaba Hetényi , Katalin Schlett , Andrea Bodor , András Perczel , László Nyitray
Alternatively spliced exon B of myosin Va is essential for binding the tail-associated light chain shared by dynein
Biochemistry 45:12582-12595. (2006) Kivonat -
Zotter A , Oláh J , Hlavanda E , Bodor A , Perczel A , Szigeti K , Fidy J , Ovádi J
Zn(2+)-induced rearrangement of the disordered TPPP/p25 affects its microtubule assembly and GTPase activity.
BIOCHEMISTRY 50:(44) pp. 9568-9578. (2011) Kivonat -
Annette Duelli , Bence Kiss , Ida Lundholm , Andrea Bodor , Maxim V. Petoukhov , Dmitri I. Svergun , László Nyitray , Gergely Katona
The C-terminal random coil region tunes the Ca²⁺-binding affinity of S100A4 through conformational activation
PLoS One 9(5):e97654 | DOI: 10.1371/journal.pone.0097654 | PMID: 24830809 (2014) Kivonat -
Andrea Bodor , László Radnai , Csaba Hetényi , Péter Rapali , András Láng , Katalin E. Kövér , András Perczel , Weixiao Y. Wahlgren , Gergely Katona , László Nyitray
DYNLL2 Dynein Light Chain Binds to an Extended Linear Motif of Myosin 5a Tail That Has Structural Plasticity
Biochemistry 53(45):7107-7122. | DOI: 10.1021/bi500574z | PMID: 25312846 (2014) Kivonat -
Andrea Bodor , Katalin E. Kövér , Lena Mäler
Membrane interactions in small fast-tumbling bicelles as studied by 31P NMR
BBA Biomembranes 1848(3):760-766. | DOI: 10.1016/j.bbamem.2014.12.001 | PMID: 25497765 (2015) Kivonat -
Anita Alexa , Gergő Gógl , Gábor Glatz , Ágnes Garai , András Zeke , János Varga , Erika Dudás , Norbert Jeszenői , Andrea Bodor , Csaba Hetényi , Attila Reményi
Structural assembly of the signaling competent ERK2–RSK1 heterodimeric protein kinase complex
Proc. Natl. Acad. Sci. USA 112(9):2711-2716. | DOI: 10.1073/pnas.1417571112 | PMID: 25730857 (2015) Kivonat -
Gergő Gógl , Anita Alexa , Bence Kiss , Gergely Katona , Mihály Kovács , Andrea Bodor , Attila Reményi , László Nyitray
Structural basis of Ribosomal S6 Kinase 1 (RSK1) inhibition by S100B Protein: modulation of the Extracellular Signal-regulated Kinase (ERK) signaling cascade in a calcium-dependent way
J. Biol. Chem. 291(1):11-27. DOI: 10.1074/jbc.M115.684928 | PMID: 26527685 (2016) Kivonat -
Gyula Pálfy , Bence Kiss , László Nyitray , Andrea Bodor
Multi-level changes in protein dynamics upon complex formation of the calcium-loaded S100A4 with a non-muscle myosin IIA tail fragment
ChemBioChem 17(19):1829-1838 DOI: 10.1002/cbic.201600280 | PMID: 27418229 (2016) Kivonat